低温冻存技术发展历程
Brief History of Cryopreservation
-
1937
1949
1959
1963
1969
1984
2009
2016
2022
2023

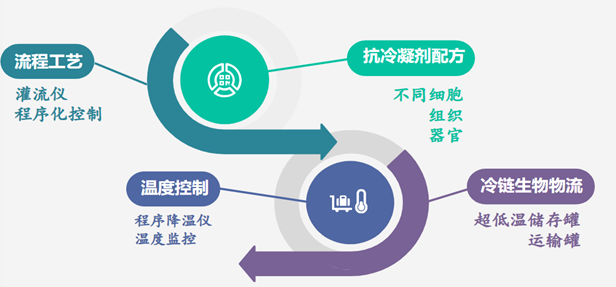
平台技术
platform technology
赛维尔生物科技公司致力于低温生物活性保存、低温物流技术研发。公司产品线包括,常低温短期和深低温无限期保存细胞、组织和器官的保存液配方,样本玻璃化深低温储存和运输设备,生物组织玻璃化冻存和复苏的自动化灌流设备及流程工艺。
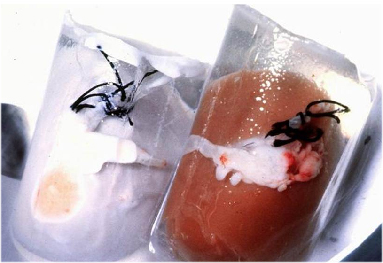
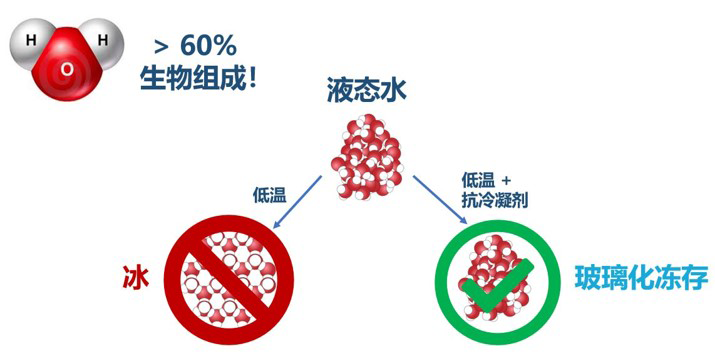
玻璃化活性保存技术
Vitrification vs Freezing
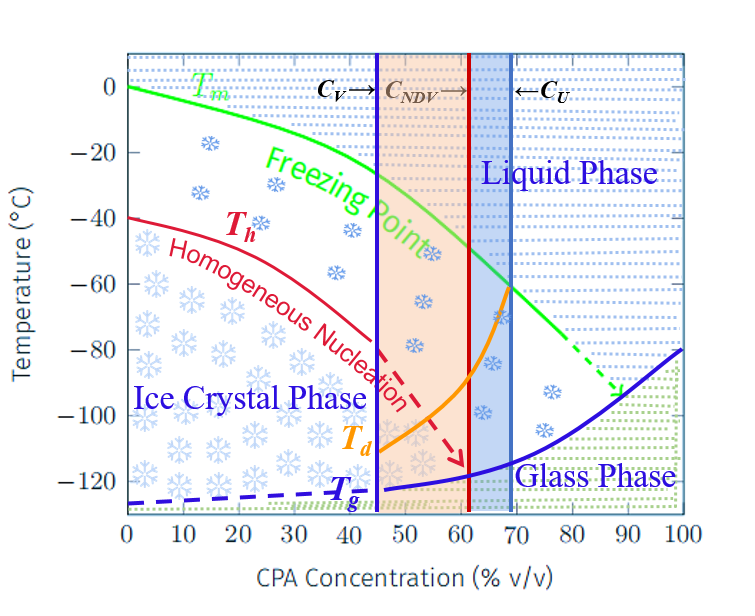
玻璃化深低温冻存是一种通过高浓度的抗冷凝保护剂和特殊的工艺流程,抑制冰晶形成,将生物样本(如细胞、组织、器官等)在深低温环境下(通常低于-130℃)保存为非晶态(玻璃态)的技术。其核心目标是避免传统冷冻过程中冰晶对细胞结构的物理损伤,从而提高冻存后的存活率和功能恢复能力,延长生物组织的保存时间。
玻璃化活性保存技术
Vitrification
传统玻璃化活性保存技术是利用高浓度抗冷凝剂配方,在无冰晶形成的情况下,使生物可以活性保存,适用于细胞、组织、器官等的冷藏,现阶段大部分应用于细胞领域。
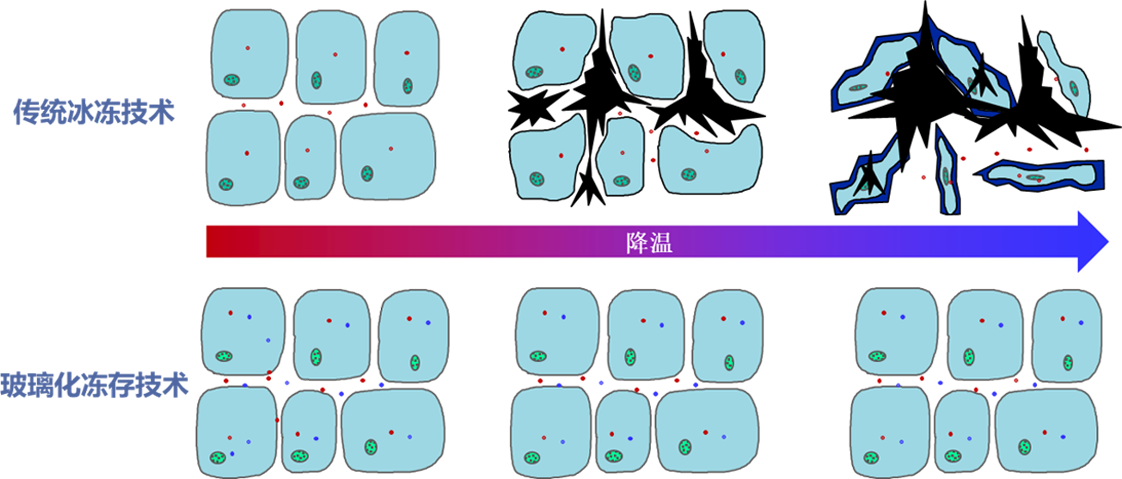



新一代玻璃化
VitriTechTM 活性保存核心技术
VitriTechTM 活性保存核心技术
VitriTech ™ 新一代玻璃化活性保存是在传统玻璃化保存技术的基础上,应用生物组织兼容性高分子聚合冰阻剂平衡配方,搭载自动化智能设备,利用个性化工艺流程,可适用于不同的细胞、组织、器官以及完整生命体,在无冰晶的情况下,使生物活性达到几乎无限期保存。
技术特点
技术自主可控 ,设备完成验证与定型

-
- 生物兼容性高分子聚合冰阻剂合成技术
- 独立创新性研发,可化学定义,不含动物源成分,具有控冰蛋白特性
-
- 系列配方平衡技术
- 实现毒性、生物兼容性、细胞损伤及可玻璃化性关键指标的最优平衡的系列配方。
-
- 适应性工艺流程
- 针对不同生物组织类型,研发平衡浓度、温控区域、时间、升降温速率等参数,实现生物组织活性的最大化保存,是突破组织、器官玻璃化冻存瓶颈的关键技术。
-
- 自动化微流控智能技术
- 业内“破冰式”创新的自动化灌流仪及辅助设备,以程序化灌流工艺控制系统及微流控分步加载为核心,实现玻璃化组织冻存的标准化及产业化。
技术优点
-
01无冰晶形成,避免造成机械损伤
-
02无渗透压巨变损伤
-
03无需手动进行精密、苛刻的温度控制
-
04存活率高
-
05适合任何组织
-
06无限期保存